放射性同位元素(RI)は、その有用性からライフサイエンス分野で広く利用されております。初めてRIを利用する場合、所属するラボのRIユーザーから実験を直接教えてもらうことが一般的ですが、その前に実験内容を簡易的に知ることができれば、RIをより身近に感じられるとの思いから「RI実験プロトコル」を作成いたしました。当協会とお取引のある国内代理店各社に協力を募り、基本的なRI実験についてのプロトコルのベースとなる情報を得て、それを元に本プロトコルとしてまとめ、このたび公開することとしました。本プロトコルがRI利用の初めの一歩となれば幸いです。
監修
飯塚 裕幸(東京大学 工学系・情報理工学系等環境安全管理室)
加藤 真介(横浜薬科大学 健康薬学科 放射線科学研究室)
原 正幸(東京医科歯科大学 統合研究機構 リサーチコアセンター)
松波 圭一(順天堂大学 大学院医学研究科 研究基盤センター アイソトープ研究室・放射線管理室)
作成協力
株式会社レビティジャパン
榎本 敦先生(東京大学・医・放射線分子医学部門)
本プロトコルへの掲載募集
本プロトコルは今後さらに充実させていく予定ですので、本プロトコルに掲載協力いただけるプロトコルをお持ちの方は以下のメールアドレスから件名「RI実験プロトコルへの掲載」でご連絡いただけますと幸いです。
Mail:shiyaku★jrias.or.jp
※ 上記の「★」記号を「@」記号 に置き換えて下さい。
目次
受容体とリガンドの結合性評価
試料中の抗原の検出、定量
その他、多様な生物学的プロセスの解析 *Scintillation proximity assay(SPA)
代謝標識
細胞障害性試験
DNAおよびRNA標識
タンパク質標識
遺伝子発現の解析
タンパク質の生合成、分解の解析
アセチル化の解析
キナーゼアッセイ
酵素活性計測
ジェネレータの作製とミルキング
吸収、分布、代謝、排泄の評価
受容体とリガンドの結合性評価
| 番号 | 実験名 | 実験概要 |
| 1 | 放射性標識リガンド結合アッセイ(総論) | 受容体の性状解析などのために、目的の受容体を含む細胞または細胞膜への放射性標識リガンドの結合を測定します。放射性標識リガンドを使用して、飽和曲線の作成、競合実験、カイネティックス測定を実施することができます。
放射性標識リガンド結合アッセイフォーマットには以下の3つがありますので、左記の各ページを参照し、特長に応じて選択してください。 ・Filtrationアッセイ ・FlashPlateアッセイ ・SPA(Scintillation proximity assay)
|
| 1-1 | Filtrationアッセイ | |
| 1-2 | FlashPlateアッセイ | |
| 1-3 | SPA(Scintillation proximity assay) |
| 2 | 35S-γ-GTP結合アッセイ(総論) | GTP結合アッセイは、GPCR(G protein-coupled receptor; Gタンパク質共役受容体)の活性化を調べるために使用される方法です。このアッセイでは、GPCRを過剰発現させた細胞膜に対する非加水分解性GTPの結合を測定します。また、細胞全体ではなく細胞膜を使用する必要があり、Gi共役受容体で最もよく機能します。
アゴニストを作用させることで、GPCRが活性化し、コンフォメーションが変化することでGタンパク質複合体の結合部位が露出します。これにより、Gαタンパク質はGDPを放出してGTPに結合できるようになります。
|
| 2-1 | SPA for 35S-γ-GTP結合 | |
| 2-2 | FlashPlateアッセイ for 35S-γ-GTP結合 | |
| 2-3 | Filtrationアッセイ for 35S-γ-GTP結合 | |
| 2-4 | 35S-γ-GTP結合アッセイのデータ解析 |
試料中の抗原の検出、定量
| 3 | ラジオイムノアッセイ(総論) | ラジオイムノアッセイ(Ridioimmunoassay:RIA)は、抗体を使用してサンプル中の抗原(分析対象)の量を検出および定量することができます。このアッセイは通常、非常に感度が高く特異的です。
高親和性の抗体(Kd = 10-8~10-11 M)を使用すると、数pg程度の抗原を検出することが可能です。基本原理は競合的結合であり、放射性標識抗原が一定数の抗体または受容体結合部位に対して非放射性抗原と競合します。
|
| 3-1 | RIA 法による血中インスリン量の測定 | |
| 3-2 | IRMA 法による血中レニン量の測定 |
その他、多様な生物学的プロセスの解析 *Scintillation proximity assay(SPA)
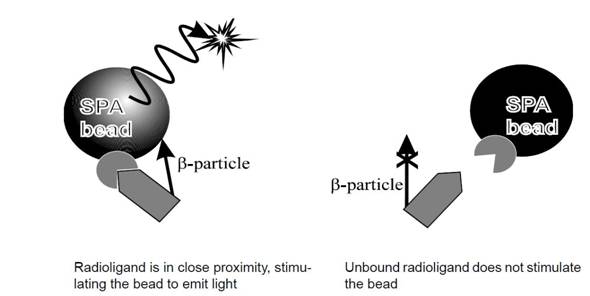
| 4 | SPA(Scintillation Proximity Assays)(総論) | Scintillation proximity assay(SPA)は、リガンド-受容体結合、酵素活性、タンパク質と核酸の分子間相互作用の研究など、多様な生物学的プロセスの解析のための迅速かつ高感度な技術です。SPAは分離ステップを経ることがなく、自動化が可能なため、ハイスループットスクリーニングに特に適しています。SPA は確立したテクノロジーで、500以上の文献に引用されています。
この技術の主な利点は、着目する生体分子、リガンド、または基質の生物学的特性を乱すことなく、3H、125I、33P、14Cのいずれかで特異的に標識できることです。 SPAビーズには以下の3つがありますので、左記の各ページを参照し、特長に応じて選択してください。 ・SPAビーズテクノロジー ・FlashPlate ・Cytostar-T プレート
|
| 4-1 | SPAビーズテクノロジー | |
| 4-2 | FlashPlate | |
| 4-3 | Cytostar-T プレート |
代謝標識
| 5 | 細胞および代謝標識(総論) | 放射性細胞標識実験では、放射性標識された化合物または前駆体(アミノ酸、DNA前駆体、または代謝前駆体など)を培地またはバッファーに添加することによって細胞に供給します。
放射性標識化合物は細胞によって生体内の代謝前駆体と同様に代謝されます。 例えば、DNA合成を測定するために放射性標識チミジンを使用します。場合によっては、代謝できない化学物質の類似体(グルコース取り込みアッセイにおけるデオキシD-グルコースなど)を使用して、放射性化学物質が代謝されずに細胞内に留まることで取り込みプロセスをモニターすることもできます。 |
| 5-1 | チミジン取り込みアッセイ(総論) | チミジン取り込みアッセイによる細胞増殖試験は、リンパ球の増殖を刺激または阻害する天然・合成化合物の能力を評価するために、免疫学、癌、幹細胞、および創薬研究で頻繁に使用されます。
このアッセイでは、細胞分裂中に生成されたDNAの複製鎖へのDNAヌクレオシドである3H-または14C-チミジンの取り込みを測定します。 細胞培養はマイクロプレートで行われ、放射性標識DNAはセルハーベスターにより捕捉され、液体シンチレーションカウンタにより計測されます。また、Cytostar-Tプレートを使用することも可能です(Cytostar-Tフォーマット)。これには、ろ過やシンチレーションカクテルの添加は必要ありません。
|
| 5-2 | 正常ヒト肺繊維芽細胞(NHLF)でのDNA合成能の測定 |
細胞障害性試験
| 6 | 51Crリリースアッセイ | Chromium-51(51Cr)リリースアッセイは、腫瘍等において、細胞毒性の正確な定量のために用いられています。また、本アッセイは、感染や薬物に反応して産生されるリンパ球の数を決定するために使用されます。
アッセイの原理としては、まず標的細胞を51Crで標識します。その後、標的細胞はエフェクター細胞によって外敵として認識され、細胞膜破裂(溶解)を起こすことで51Crが放出されます。51Crは、サンプルを遠心分離し、上清を収集することによって分離できます。遠心分離の上清は、ガンマカウンタで直接カウントするか、マイクロプレートでシンチレーションカクテルと混合して、液体シンチレーションカウンタで検出できます。
|
DNAおよびRNA標識
| 7 | DNAおよびRNA標識(総論) | RI標識した核酸プローブとして、特定の塩基配列を持った核酸や核酸結合タンパク質を検出できます。得られた標識プローブは、in situハイブリダイゼーション、サザンブロッティング、ノーザンブロッティングなどの用途に使用できます。
|
| 7-1 | 製品の選択とポイント |
タンパク質標識
| 8 | タンパク質の125I標識 | タンパク質のヨウ素標識は、目的のタンパク質に高い比放射能でトレーサーを加える一般的な方法であり、標識した化合物はリガンドバインディングアッセイや、RIA等に用います。
標識方法にはいくつかの方法があり、標識されるアミノ酸や使用される反応条件が異なりますので最適な方法を選択してください。一般的に使用されるのはボルトンハンター試薬を用いた方法です。 ヨウ素の放射性同位体の半減期は比較的短く(125Iで60日、131Iでは8日)、ヨウ素標識されたタンパク質は放射性同位体崩壊による活性の喪失および分解を受けやすくなります。したがって、ヨウ素標識タンパク質は標識後30日以内に使用する必要があります。 |
遺伝子発現の解析
| 9 | CATレポーター遺伝子アッセイ | クロラムフェニコールアセチルトランスフェラーゼ(chloramphenicol acetyltransferase, CAT)レポーター遺伝子アッセイは、遺伝子導入された細胞におけるプロモーター遺伝子の発現を評価するための方法であり、細胞シグナル伝達経路の活性計測に欠かせません。
このアッセイにおいて、標的プロモーター配列が、動物細胞には存在しない細菌のCAT酵素をコードするDNA配列に融合されます。この酵素は、主にクロラムフェニコールのアシル化を触媒します。生成されたアセチル-クロラムフェニコール(AcCAM)を定量することにより、プロモーターの活性を測定できます。 |
タンパク質の生合成、分解の解析
| 10 | 放射性標識メチオニン(35S) | 35S-メチオニンや35S-システインなどの低エネルギーβ線放出核種による細胞の代謝標識は、生体内でのタンパク質の生合成、成熟、分解をトレースするためによく使用されます。
細胞内のメチオニン含有タンパク質の35S標識は、メチオニンを含まない培地を使用します。放射性標識タンパク質の定量と同定は、2次元SDS-PAGEゲルで分離し、オートラジオグラフィーまたはリン光イメージングにより測定します(他の検出方法も可能です)。 網状赤血球溶解物または小麦胚芽抽出物を使用した無細胞タンパク質翻訳にも35S-メチオニンを使用することができます。 |
アセチル化の解析
| 11 | アセチルCoAを使用したアセチル化アッセイ | 3Hおよび14C-アセチルCoAは、ヒストンおよびその他のタンパク質のin vitroアセチル化を研究するために使用される放射性標識基質です。
アセチル化は通常、タンパク質やペプチドのN末端、またはタンパク質内のリジン残基で起こります。また、アセチル化の実験は、3H標識酢酸ナトリウムを使用することも可能です。脱アセチル化アッセイ用の放射性基質は、放射性標識酢酸塩を使用します。 ヒストンのリジン残基のアセチル化と脱アセチル化は、エピジェネティックな調節に重要な役割を果たします。アセチル化は負電荷を与え、ヒストンの正電荷を中和し、負に帯電したDNAの結合を減らします。これによりクロマチン構造が緩み、転写に関わる分子群がDNAにアクセスできるようになります。ヒストンのアセチル化状態は、2つの酵素(ヒストンアセチルトランスフェラーゼ(HAT)とヒストンデアセチラーゼ(HDAC))によってバランスが保たれています。HATおよびHDACは、ヒストンタンパク質以外のものをアセチル化および脱アセチル化することもできます。
|
キナーゼアッセイ
| 12 | 放射性リン酸化アッセイ(総論) | in vitroキナーゼアッセイは、32Pまたは33P標識ATPを使用して行われます。このアッセイでは、ATP(場合によってはGTP)から基質へのγリン酸の転移を測定し、カイネティクス解析やスクリーニングに使用できます。また、ペプチド、タンパク質、脂質、低分子化合物など、基本的にあらゆる種類の基質に適応可能です。
ロースループットで実験する場合、チューブまたはバイアルで行われ、未反応の放射性標識ATPはゲル電気泳動、ろ過、密度勾配遠心分離、またはクロマトグラフィーによって基質から分離されます。ハイスループットの場合、SPAまたはFlashPlateアッセイを使用します。 細胞ベースのアッセイでは、標識されたATPではなく、32Pまたは33Pオルトリン酸または他のリン酸塩を使用します。 |
| 12-1 | In vitroキナーゼアッセイ |
酵素活性計測
| 13 | REA 法によるアンギオテンシン転換酵素(ACE)の活性測定 | Radioenzymatic assay(REA)は、トレーサ法を利用した酵素活性測定法の一つです。
ある酵素の基質として標識化合物を用い、標識された部分を含む生成物を適当な方法で分取し、その放射能を検出することにより、その酵素の活性を測定します。 |
ジェネレータの作製とミルキング
| 14-1 | 68Ge/68Gaジェネレータの作製と68Gaミルキングの実施 | 放射平衡にある親核種と娘核種から、娘核種のみを繰り返し分離する目的で作成されたセットはアイソトープジェネレータ(またはジェネレータ)と呼ばれ、放射性同位元素を用いた診断・治療や化学実験に応用されています。
ジェネレータの主要部分は、多くの場合、親核種を固定したまま共存する娘核種だけを取り出すためのクロマトグラフィカラムです。このカラム に親核種を吸着させておき、溶離液を流して娘核種だけを溶出させます。カラムの充填剤としてはイオン交換樹脂、無機酸化物イオン交換体などが多く用いられます。 ここでは、ジェネレータの作製と、娘核種を用いた実験例を示します。 |
| 14-2 | 137Cs/137mBa ジェネレータの作製と 137mBa ミルキングの実施 |
吸収、分布、代謝、排泄の評価
| 15-1 | Caco-2 細胞層での薬物の膜透過性試験(3H 化合物、14C 化合物等) | 特定の薬物の吸収率をin vitroから予測する実験系として、培養細胞を用いた薬物の膜透過試験があります。ここでは、ヒト結腸癌由来の細胞株であるCaco-2細胞を用いた、ヒト経口吸収量や速度の求め方を示します。 |
| 15-2 | ラット、マウスを用いたADME 試験 | RI標識した化合物を用いて、ラット、マウスにて吸収、分布、代謝、排泄を評価する手法です。 |
| 15-3 | 放射性セシウムのイネへの取り込み | 植物内で元素そのものの分布や動きを評価する手法です。 |
問い合わせ先
公益社団法人日本アイソトープ協会
医薬品・試薬課
TEL:03-5395-8033 (平日 9:20~17:30)
FAX:03-5395-8055 (0120-012895 注文専用)
Mail:shiyaku★jrias.or.jp
※ 上記の「★」記号を「@」記号 に置き換えて下さい。